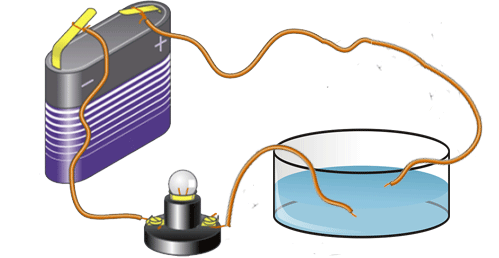
La transferencia de calor implica el transporte de calor en un volumen y la mezcla de elementos macroscópicos de porciones calientes y frías de un gas o un líquido. Se incluye también el intercambio de energía entre una superficie sólida y un fluido o por medio de una bomba, un ventilador u otro dispositivo mecánico (convección mecánica, forzada o asistida).
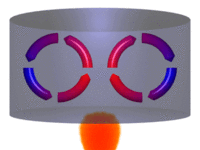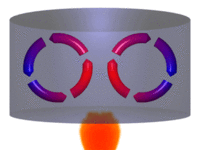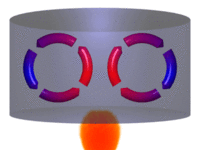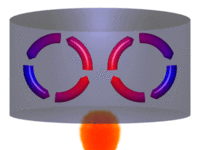 |
| Movimiento por convección |
La convección es una de las tres formas de transferencia de calor y se caracteriza porque se produce por medio de un fluido (líquido o gas) que transporta el calor entre zonas con diferentes temperaturas. La convección se produce únicamente por medio de materiales fluidos. Lo que se llama convección en sí, es el transporte de calor por medio del movimiento del fluido, por ejemplo: al trasegar el fluido por medio de bombas o al calentar agua en una cacerola, la que está en contacto con la parte de abajo de la cacerola se mueve hacia arriba, mientras que el agua que está en la superficie, desciende, ocupando el lugar que dejó la caliente.

En la transferencia de calor libre o natural un fluido es más caliente o más frío y en contacto con una superficie sólida, causa una circulación debido a las diferencias de densidades que resultan del gradiente de temperaturas en el fluido.
La transferencia de calor por convección se expresa con la Ley del Enfriamiento de Newton:
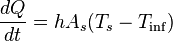
Donde
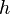 es el coeficiente de convección (ó coeficiente de película),
es el coeficiente de convección (ó coeficiente de película), 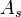 es el área del cuerpo en contacto con el fluido,
es el área del cuerpo en contacto con el fluido,  es la temperatura en la superficie del cuerpo y
es la temperatura en la superficie del cuerpo y  es la temperatura del fluido lejos del cuerpo.
es la temperatura del fluido lejos del cuerpo.